
生命科学光学

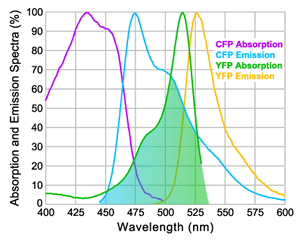
荧光共振能量转移 (FRET) 是一种在分子尺度上表征距离相关相互作用的强大技术。它是为数不多的能够测量 体内 和 体外 分子间和分子内距离相互作用的工具之一。 FRET 涉及通过其吸收光谱内的入射光激发供体荧光团。这种辐射吸收将供体荧光团提升到更高能量的激发态,该激发态通常会以特征发射光谱辐射衰减(返回基态)。如果另一个荧光团分子(受体)存在于供体附近,其能量状态的特征是吸收光谱与供体的发射光谱重叠,则供体和受体之间存在非辐射能量转移的可能性。图 1 显示了青色荧光蛋白(CFP)发射光谱和黄色荧光蛋白(YFP)吸收光谱的重叠;这对荧光蛋白支持强大的 FRET 相互作用。
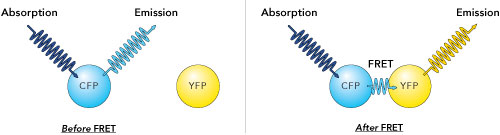
能量转移由供体和受体荧光团分子之间的偶极 - 偶极相互作用(范德华力)介导,其变化为两个分子之间距离的倒数 6 次方。从供体到受体的能量转移速率大约为 kF
kF ~ kD(r0/r)6
其中 kD 是供体荧光团的辐射衰减率,或在没有受体荧光团的情况下荧光发射寿命的倒数(通常为 1 – 50 ns),r 是两个分子之间的距离, r0 是“Förster 距离”,表征能量传输的 50% 效率点。FRET 适用于测量 Förster 距离数量级的距离变化,通常为 20 到 90 Å.
在能量从供体转移到受体后,受体荧光团被激发到其荧光发射状态。因为从受体观察到的荧光发射速率受从供体到受体的能量转移的速率限制,所以,FRET 发射的定量测量可以使用上述方程提供距离的推断测量。准确的 FRET 测定通常涉及比较有和没有受体存在的样品中的供体和供体 - 受体荧光发射强度。比率测量是必要的,因为,如图 1 所示,供体和受体发射光谱之间通常存在重叠,因此,很难通过单次测量准确确定使用受体发射滤光片测量的荧光的哪一部分仅来自受体。荧光寿命测量为能量转移率提供更直接的结果,不易受浓度变化的影响,并且可以使用时域或相位调制寿命测量技术进行。
FRET 应用通常以非常低的分子荧光团浓度为特征。使用精心优化的滤光片对于检测微弱的荧光发射信号至关重要。Semrock BrightLine® 荧光滤光片提供尽可能高的透射率,以提高 FRET 发射信号,以及精心优化的透射通带深度阻挡,以实现高的信号背景比。
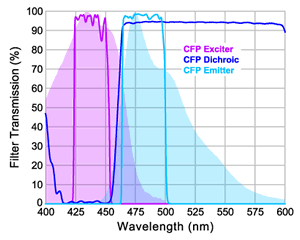
图 2:用于定量测量供体发射的 CFP 激发片、二向色镜和发射片(来自 BrightLine FRET-CFP/YFP-A 滤光片组)
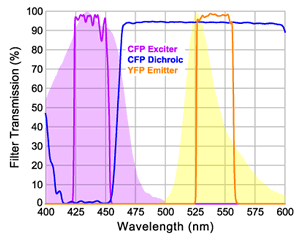
图 3:带有 YFP 发射滤光片(来自 BrightLine FRET-CFP/YFP-A 滤光片组)的CFP 激发片和二向色滤光片,用于受体发射的定量测量。
图 2 和图 3 显示了 Semrock CFP/YFP 的
FRET 滤光片组的透射光谱 ;图2中的滤光片用于量化
仅来自供体的荧光(在本例中为CFP)
图 3 中的滤光片用于量化受体的 FRET 荧光
(YFP)。
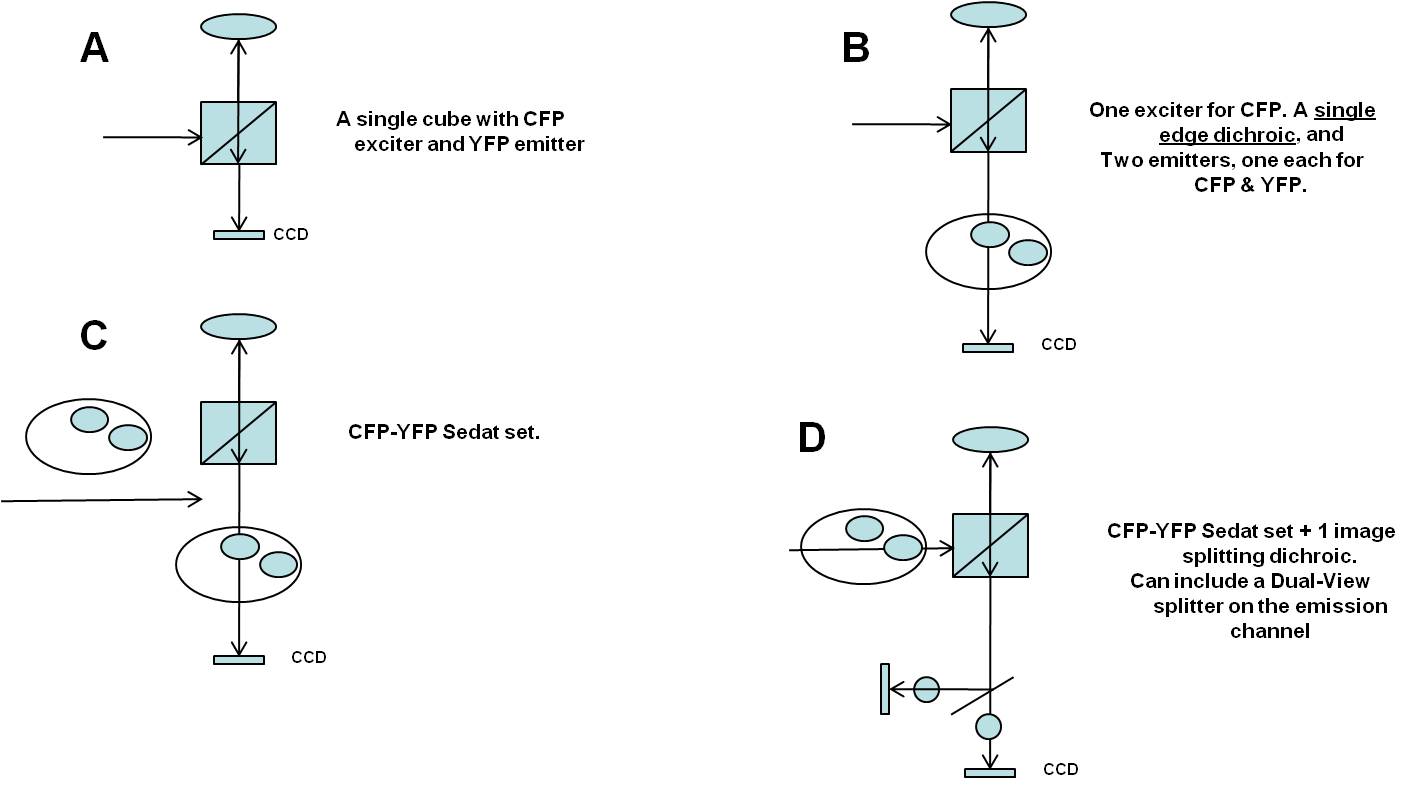
可以使用两个不同的滤光片组(立方体)依次进行这两个测量,其中每个滤光片组(立方体)具有相同的激发滤光片和二向色镜滤光片,但发射滤光片不同。不推荐这种方法,因为滤光片立方体之间的像素偏移会使测量结果失真,并且更换滤光片立方体需要相对较长的时间并导致样品振动,从而影响感兴趣分子之间的距离。相反,建议使用低振动的滤光片切换或真正同时检测供体和受体发射,尤其是在对移动的活细胞样本执行 FRET 时。对于那些选择使用两个单独的滤光片立方体的人来说,选择旨在消除像素偏移的滤光片组很重要,以获得准确的测量值。
使用发射滤光轮可以实现低振动的滤光片更换。这是用于宽视场 FRET 测量的常见的显微镜配置。一些研究人员更喜欢使用双滤光片转轮系统(一个用于激发片,一个用于发射片),尽管这种系统在软件控制方面更昂贵且更复杂。对于双滤光片转轮系统,好的滤光片组选择是 Sedat 多波段组。还可以使用两个摄像头同时检测供体和受体发射通道。一些制造商为此应用制造显微镜附件。除了标准的 FRET 滤光片组外,还需要一个额外的二向色分束镜来分隔附件中的两个发射路径。
Published: 13 November 2022 - Nature.com - Communications Biology volume 5, P: 1-6
…For observations using Sumire, a dichroic mirror (FF365-Di01-25×36; Semrock), an excitation filter (F01-334/40-25; Semrock), and an emission filter (FF01-417/60-25; Semrock) were used. A 340 nm LED line of LEDhub (Omicron) was used as the excitation light. To observe the blue fluorescence from VFP1, a dichroic mirror (Di01-R405/488/561/635; Semrock), an excitation filter (FF01-405/10-25; Semrock), emission filters (FF02-447/60-25; Semrock), and a 400 nm LED line of LEDhub were used. In the P2A assay, the emission filters were replaced with filters (FF01-440/40-25; Semrock) optimized for Sirius rather than for Sumire. For mCherry observation, a dichroic mirror (FF593-Di03-25×36; Semrock), an excitation filter (FF01-562/40-32; Semrock), fluorescence filters (FF02-641/75-32; Semrock), and a 550 nm line of an LED light source, Niji (blue box optics), were used. For FRET imaging using a Sumire-T-sapphire pair, the excitation light source, dichroic mirror, and excitation filter were the same as those in the Sumire observation above. The emission filter was switched between the violet channel (FF01-417/60-25; Semrock) and green channel (FF02-520/28-32; Semrock). For FRET imaging using Ateam 1.03, a dichroic mirror (FF458-Di02-32×44; Semrock), an excitation filter (FF01-425/30-25; Semrock), and a 455 nm LED line of LEDhub were used. The emission filter was switched between the cyan channel (FF01-483/32-32) and the yellow channel (FF01-542/27-32; Semrock)....
新型滤光片改变了高速多色荧光成像 2006 年 3 月 的 BioPhotonics 杂志
滤光片影响图像 (2003 年 11 月)
J. R. Lakowicz, "荧光光谱原理" (Kluwer Academic / Plenum Publishers, New York, 1999).
Paul R. Selvin, "荧光共振能量转移的复兴," 自然结构生物学, Vol. 7, No. 9, pp. 730-734 (2000).
荧光探针和研究产品手册, 分子探针公司, www.probes.com/handbook.